Хімія в житті людини.
Професії майбутнього

Амінокислоти.Білки.
Професії майбутнього
Теми для творчого завдання:історія виникнення, застосування та короткий опис лікарських препаратів, композитних матеріалів , сплавів, будівельних матеріалів, агрохімія.

Амінокислоти.Білки.
1. Загальна характеристика амінокислот
 Амінокислоти — органічні сполуки, в молекулі яких одночасно містяться дві функціональні групи: аміногрупа -NH2 і карбоксильна група -СООН.
Амінокислоти — органічні сполуки, в молекулі яких одночасно містяться дві функціональні групи: аміногрупа -NH2 і карбоксильна група -СООН.
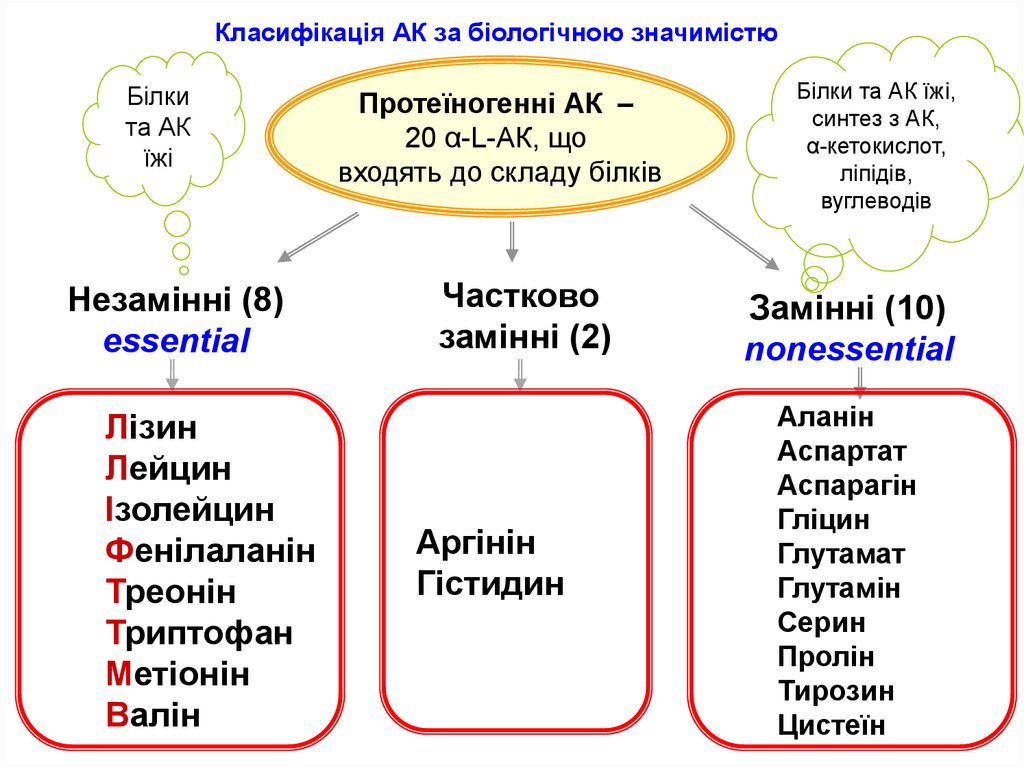
Білки складаються із залишків молекул амінокислот сполучених пептидними зв'язками.
Двадцять амінокислот, з яких побудовані білки, називають стандартними або протеїногенними амінокислотами.
У залежності від того, до якого атому Карбону приєднана аміногрупа, амінокислоти поділяються на α-, β-, γ- тощо. У α-амінокислотах карбоксильна група і аміногрупа приєднані до одного атома Карбону.
Усі протеїногенні амінокислоти є α-амінокислотами. Їх загальна формула:
2. Номенклатура амінокислот
За систематичною номенклатурою назви амінокислот утворюються від назв відповідних карбонових кислот додаванням префікса аміно- і номера атома, від якого відходить аміногрупа. Наприклад: 2-амінобутанова кислота.
Для α-амінокислот, які входять до складу білків, використовують тривіальні назви.
Білки.
Структура білків
- Первинна структура – послідовне лінійне сполучення залишків амінокислот, сполучених пептидними зв’язками
- Вторинна структура – спіраль, витки якої сполучені водневими зв’язками
- Третина структура – глобула або фібрила, зв’язки водневі, гідрофобні, йонні
- Четвертинна структура – поєднання кількох білкових молекул, зустрічається лише в частини білків. Найвідоміший білок з четвертинною будовою молекули — гемоглобін.
- Хімічні властивості білківДенатурація білка — це руйнування четвертинної, третинної і вторинної структури білка. Вона може бути викликана нагріванням, дією радіації, струшуванням. Денатурація білка відбувається при варінні яєць, приготуванні їжі тощо.Ренатурація — це процес, оборотний денатурації, при якому білки, повертають свою третинну і вторинну структуру.Денатурація — руйнування вищих рівнів структурної організації білка – вторинной, третинної, четвертинної.Денатурація буває оборотна і необоротна.Оборотна денатурація — від механічної дії, солей, слабких кислот.Процес відновлення структури білка називається ренатурація.Необоротна денатурація — вплив високої температури, концентрованих розчинів кислот, лугів, солей важких металів.
Якісна реакція на білок

Вуглеводи
Олігосахариди складаються з декількох (до 10)
моносахаридів, з'єднаних ковалентними зв'язками. При гідролізі вони
розпадаються на що входять до їх молекули моносахариди. Найбільш поширені
дисахариди, такі як: сахароза (харчової або тростинний цукор), що містить у
своїй молекулі залишки глюкози і фруктози, лактоза (молочний цукор), що
складається із залишків глюкози і галактози, і мальтоза (солодовий цукор) містить два залишки
глюкози.
Полісахариди являють собою довгі нерозгалужені або розгалужені ланцюги, що
включають сотні, тисячі моносахаридів. Найчастіше полісахариди складаються з
глюкози. Найбільш поширені такі полісахариди: целюлоза (клітковина), крохмаль,
глікоген, хітин(азотовмісний полісахарид). Всі вони складаються тільки з
залишків глюкози та її похідних.
Фізико-хімічні
властивості вуглеводів.
1.Розчинність у воді. Моносахариди дуже легко розчиняються у воді, легко утворюють сиропи, з яких
виділити в кристалічному вигляді буває дуже важко.
2.Як і у всіх альдегідів, окиснення моносахаридів
призводить до відповідних кислот. Так, при окисленні глюкози аміачним розчином
гідрату окису срібла утворюється глюконовая кислота (реакція "срібного
дзеркала").
3. Якісна реакція на глюкозу.
4. Відновлення. Відновлення цукрів призводить до багатоатомним спиртів. Як відновлювача
використовують водень в присутності нікелю, алюмогідрид літію та ін.
5. Бродіння глюкози.
Жири
(період опрацювання 13.04.2020)
Домашнє завдання постер-реклама корисного для вживання жиру.
У природних хімічних лабораторіях – живих організмах – із
трьохатомного спирту гліцеролу і вищих карбонових кислот – пальмітинової,
стеаринової, олеїнової та деяких інших утворюються жири.
Жири – це естери, утворені триатомним спиртом – гліцерином й трьома молекулами вищих карбонових кислот.
• олеїнова C17H33COOH;
• лінолева C17H31COH;
• ліноленова C17H29COOH.
Загальна назва жирів — тригліцериди.
Жири – це естери, утворені триатомним спиртом – гліцерином й трьома молекулами вищих карбонових кислот.
• олеїнова C17H33COOH;
• лінолева C17H31COH;
• ліноленова C17H29COOH.
Загальна назва жирів — тригліцериди.
Приклади
природних жирів
• Лляна олія:
61,6 % гліцеридів лінолевої кислоти.
• Соняшникова,
горіхова олії: 30-B0 % гліцеридів лінолевої
кислоти, решта — олеїнової кислоти.
В організмі людини основну частину жирів становлять тригліцериди. Крім них жирами називають фосфоліпіди, стероли (в тому числі холестерол).
В організмі людини основну частину жирів становлять тригліцериди. Крім них жирами називають фосфоліпіди, стероли (в тому числі холестерол).
Відомий
шведський хімік і фармацевт. Шеєле Карл Вільгельм у 1779 році за допомогою
гідролізу жирів виявив, що одним із його з продуктів є гліцерол.
У першій
чверті ХІХ століття, в 1811 році, французький учений М. Шеврель установив
хімічний склад жирів. Перший синтез жироподібної речовини здійснив його
співвітчизник М. Бертло (1854р.), нагріваючи гліцерол зі стеариновою кислотою.
Фізичні властивості. Жиру в клітинах небагато – лише 5-15% від їх маси.
У жировій тканині під шкірою і в сальнику до 90% жиру, у молоці 2-6%, (в молоці дельфінів до 40%). У рослинах жир
зосереджений в насінні, плодах. Жири легші за воду, у воді погано розчиняються, але добре
розчиняються в органічних розчинниках. Природні жири являють собою не індивідуальну
речовину, а суміш тригліцеридів. Жири тваринного походження тверді(виключення риб’ячий
жир), бо містять залишки насичених кислот. Рослинні жири(олії) рідкі (виключення
пальмовий жир), бо містять залишки ненасичених кислот
 |
| Марселен Бертло |
 |
| Мішель Шеврель |
 |
| Карл Вільгельм Шеєллє |
Так звані «висихаючи олії» мають здатність висихати,
тобто ставати твердими й утворювати при цьому міцну прозору тонку плівку.
Завдяки цьому їх використовують для добування оліфи, яку застосовують для
вироблення масляних фарб, клейонок, лінолеуму.
Хімічні властивості.
При довгому зберіганні на повітрі жири частково окиснюються киснем й гіркнуть.
Гідроліз (омилення) Протікає в присутності каталізаторів (кислот, лугів, оксидів Магнію, Кальцію, Цинку).
Хімічні властивості.
При довгому зберіганні на повітрі жири частково окиснюються киснем й гіркнуть.
Гідроліз (омилення) Протікає в присутності каталізаторів (кислот, лугів, оксидів Магнію, Кальцію, Цинку).
Якщо
замість води взяти луг, то в результаті гідролізу одержують солі вищих
карбонових кислот — мила (тверде — натрієве, рідке — калієве).
Промислове
значення має реакція гідрування жирів. У результаті рідкі жири (такі, що
містять ненасичені кислоти) перетворюються на тверді (які містять лише насичені
кислоти).
Що таке транс жири
Корсні і шкідливі жири в харчуванні людини
Вищі карбонові кислоти. Мило
(період опрацювання 06.04.2020-10.04.2020)
Перевірочний тест №3 Карбонові кислоти,мило для скачування
Вищі карбонові кислоти (ВКК) - карбонові
кислоти, що містять у молекулах від 12 до 22 атомів Карбону.
Насичені вищі карбонові кислоти - містять лише одинарні хімічні
зв’язки:
- пальмітинова кислота: СН3-(СН2)14-СООН
або С15Н31СООН
-стеаринова кислота: СН3-(СН2)16-СООН,
або C17H35COOH Ненасичені вищі карбонові кислоти -
містять кратні зв’язки:
-олеїнова: С17Н33СООН,
або СН3-(СН2)7-СН=СН-(СН2)7-СООН
- лінолева: С17Н31СООН,
або СН3-(СН2)4-СН=СН-СН2-СН=СН-(СН2)7-СООН
- ліноленова: С17Н29СООН,
або СН3-CH2-CH=CH-CH2-CH=CH-CH2-СН=СН-(СН2)7-СООН
Мила - солі вищих
карбонових кислот з лужними металами. На відміну від вищих карбонових кислот
добре розчиняються у воді.
Молекули
вищих карбонових кислот є неполярними і тому утруднене їхнє розчиняння у воді.
Солі вищих карбонових кислот мають йонну будову, а йонні сполуки краще розчиняються у воді, ніж
молекулярні.
Пояснення мийної дії мила: полярна частина аніону солей ВКК є гідрофільною («прагне» до
водного оточення). Вуглеводневий ланцюг, навпаки, є гідрофобною частиною
(намагається «втекти» з водного оточення). Завдяки цьому у водному розчині солі
ВКК утворюють специфічні частинки — міцели: в одному місці збирається багато
аніонів ВКК, які орієнтуються так, щоб гідрофобні хвости були спрямовані
всередину такої частинки, а гідрофільні «головки» - назовні, тобто до води.
Завдяки утворенню міцел солі ВКК мають досить велику розчинність у воді й
виявляють мийну дію. Краплинки жиру та інші частинки бруду є гідрофобними: якщо
вони перебувають поблизу міцел, то «ховаються» від води усередині міцел і в
такому вигляді плавають у воді. У такий спосіб жир стає розчинним у воді. Якщо
бруд прилип до якоїсь поверхні, дія поверхнево-активних речовин (ПАР) буде
такою самою: частинки ПАР оточують бруд, відривають його від поверхні й
оточують з усіх боків, завдяки чому частинки бруду стають водорозчинними. Якщо
промити поверхню водою, то бруд змиється з милом і поверхня буде чистою.
Полярні групи молекул ПАР
повертаються до води, оскільки вони є гідратованими, а вуглеводневі радикали
виштовхуються з водної фази. Обидва ці процеси супроводжуються вивільненням теплоти,
це сприяє зменшенню енергії системи і є енергетично вигідним.
10 цікавих фактів про мило
Карбонові кислоти
(період опрацювання 30.03-03.04.2020)
Написати конспект, оформити досліди як лабараторні дослідження, виконати підсумковий тест.
.1. Поняття про карбонові кислоти
Карбонові кислоти — oрганічні речовини, молекули яких
складаються з вуглеводневого радикала та карбоксильної групи -СООН.
Група -СООН називається функціональною групою
карбонових кислот.
Загальна формула карбонових кислот RСООН, або СnH2n-1COOH
Назви карбонових кислот за систематичною номенклатурою
утворилися від назв насичених вуглеводнів з додаванням закінчення –ова кислота.
Тривіальні назви карбонових кислот склалися традиційно.
HСООH – метанова кислота – мурашина
СН3СООН – етанова кислота – оцтова
С2Н5СООН – пропанова кислота – пропіонова
С3Н7СООН – бутанова кислота – масляна
С4Н9СООН – пентанова кислота – валеріанова
2. Фізичні властивості оцтової кислоти
 являє собою кристалічну масу або прозорий безбарвний
леткий розчин з гострим характерним запахом рідина, добре розчинна у воді, має кислий смак.
являє собою кристалічну масу або прозорий безбарвний
леткий розчин з гострим характерним запахом рідина, добре розчинна у воді, має кислий смак.
Карбонові кислоти — oрганічні речовини, молекули яких
складаються з вуглеводневого радикала та карбоксильної групи -СООН.
Група -СООН називається функціональною групою
карбонових кислот.
Загальна формула карбонових кислот RСООН, або СnH2n-1COOH
Назви карбонових кислот за систематичною номенклатурою
утворилися від назв насичених вуглеводнів з додаванням закінчення –ова кислота.
Тривіальні назви карбонових кислот склалися традиційно.
HСООH – метанова кислота – мурашина
СН3СООН – етанова кислота – оцтова
С2Н5СООН – пропанова кислота – пропіонова
С3Н7СООН – бутанова кислота – масляна
С4Н9СООН – пентанова кислота – валеріанова
2. Фізичні властивості оцтової кислоти
Хімічні властивості
1. Горить
СН3СООН + 2О2 → 2СО2 + 2Н2О
. За
хімічними властивостями оцтова кислота подібна до мінеральних кислот. У водних
розчинах вона дисоціює на іони:
СН3СООН ⇆ СН3СОО- +
Н+.
Кислотний залишок СН3СОО називається
ацетат-іоном. Оскільки оцтова кислота належить до слабких електролітів, то
іонів водню і ацетат-іонів утворюється мало.
Як і мінеральні кислоти,
оцтова кислота взаємодіє з металами, основами, основними оксидами і солями, що використовується
для добування її солей — ацетатів.
Взаємодія з металами.
2СН3СООН + Zn → (CН3СОО)2Zn + H2
Взаємодія з основними оксидами.
2СН3СООН + CuО → (CН3СОО)2Cu + H2О
Взаємодія з основами.
СН3СООН + NaOH → CН3СООNa + H2О
Взаємодія з солями.
2СН3СООН + Na2СО3 → 2CН3СООNa + H2О + СО2
Реакція з спиртами, утворюються естери
СН3СООН + С2Н5ОН → 2CН3СООС2Н5 + H2О
Якісна реакція на ацетат-іон
3СН3СООNa + FeCl3 → (CН3СОО)3Fe + 3NaCl
Добування. Сучасний
синтетичний спосіб добування оцтової кислоти оснований на окисненні оцтового
альдегіду, який, у свою чергу, добувають з ацетилену за реакцією Кучерова
(ацетилен добувають з досить доступної природної сировини
— метану):
Великого значення
набуває новий спосіб добування оцтової кислоти окисненням бутану. На відміну від процесу
добування оцтової кислоти з метану, який є багатостадійним (метан —>
ацетилен 4 оцтовий альдегід −>оцтова кислота), добування її окисненням
бутану скорочує число стадій, що дає великий економічний ефект.
Застосування.
Застосування оцтової кислоти досить різноманітне. В хімічній промисловості її
використовують для виробництва пластичних мас, різних барвників, лікарських
речовин, штучного волокна (ацетатного шовку), незаймистої кіноплівки та ін. Як
протраву при фарбуванні тканин застосовують солі оцтової кислоти — алюмінієві,
хромові та залізні. Солі оцтової кислоти використовують також для боротьби зі
шкідниками сільського господарства. Оцтову кислоту вживають як приправу до їжі,
а також для консервування овочів.
.jpg) |
| Фрідріх Велер |
Органічні речовини.
Історія розвитку органічної хімії.
Назва «органічна хімія» походить з припущення що органічні сполуки можуть бути синтезовані тільки в живих організмах
.jpg) |
| Бертло Марселен |
Термін “органічна хімія” вперше запровадив в 1806 році шведський хімік Берцеліус. Вважалось, що всі органічні речовини можуть бути синтезовані тільки в живих організмах. Думали, що вони утворюються тільки під дією особливої “життєвої сили”, яка існує лише в живій природі: в організмі тварин і в рослинах.
Спростували ці уявлення такі події:
- Німецький дослідник Фрідріх Велер (1828 р) вперше синтезував сечовину.
- Німецький хімік Кольбе (1845 р) синтезував оцтову кислоту.
- Француз Бертло (1851 р) синтезував бензол, фенол, нафталін, тваринний жир.
- Росіянин Олександр Михайлович Бутлеров (1961) синтезував цукристу речовину.
 |
| Кольбе |
Ці синтези стали початком бурхливого розвитку органічної хімії.
Предмет органічної хімії.
Кекуле (1851 р) визначив органічну хімія, як хімію сполук Карбону.
Органічна хімія – це хімія сполук Карбону.
Хоча є й неорганічні сполуки Карбону: СО, СО2, СаСО3, Н2СО3 та інші.
.jpg) |
| О.М..Бутлеров |
Задачі на знаходження молекулярної формули органічної речовини
Знаходження формули сполуки за масовими частками елементів
Алгоритм
1. Прочитайте задачу і складіть її стислу умову.
2. Обчисліть молярну масу органічної сполуки за формулою відносної густини газів.
3. Обчисліть кількість атомів елементів у складі органічної сполуки за формулою масової частки хімічного елемента у складній речовині.
4. Вкажіть молекулярну формулу органічної речовини.
Якщо за умовою задачі відсутні відомості, за якими можливо обчислити молярну масу органічної речовини, то в такому випадку визначають емпіричну формулу речовини. Задачі такого типу розв’язують за іншим алгоритмом:
1. Прочитайте задачу і складіть її стислу умову.
2. Обчисліть маси елементів, які входять до складу органічної сполуки
3. Визначте молярні маси елементів, що входять до складу органічної сполуки.
4. Обчисліть кількості елементів у складі органічної сполуки.
5. Запишіть кількісне співвідношення елементів, що входять до складу органічної сполуки, і вкажіть її емпіричну формулу.
Тренувальні задачі
1. Вивести молекулярну формулу вуглеводню за такими даними:
ω(С) = 85, 7%, а відносна густина за воднем дорівнює 21.
2. Масова частка Карбону та Гідрогену в органічній сполуці відповідно дорівнюють 84,51 та 15,49%. Відносна густина речовини за киснем дорівнює 4,44. Вивести молекулярну формулу речовини.
3. Аналіз деякої газуватої органічної речовини показав, що масова частка Карбону в ній дорівнює 81,81%, а Гідрогену 18,19%. Відносна густина цієї речовини за воднем дорівнює 22. Вивести молекулярну формулу речовини.
4. Аналіз деякої органічної речовини показав, що масова частка Карбону в ній дорівнює 24,34%, Гідрогену 4,04%, Хлору 71,71. Відносна густина цієї речовини за воднем дорівнює 49,5. Вивести молекулярну формулу речовини.
5. Масові частки Карбону та Гідрогену у циклоалкані відповідно дорівнюють 85,7 та 14,3%. Відносна густина цієї речовини за воднем дорівнює 35. Вивести молекулярну формулу речовини.
6. Хлолрпохідне насиченого вуглеводню має відносну густину за повітрям 8,16. Масові частки Карбону та Хлору відповідно дорівнюють 10,1% та 89,9%. Вивести молекулярну формулу речовини.
7. Встановіть формулу органічної сполуки, що містить атоми Карбону, Гідрогену й Оксигену, масові частки яких відповідно становлять 40, 6,66 і 53,34%
8. Виведіть молекулярну формулу вуглеводню, якщо масова частка Карбону складає 82,8%.
|
Знаходження молекулярної формули органічної речовини за продуктами згоряння
|
Алгоритм
1. Прочитайте задачу і складіть її стислу умову.
2. Запищіть схему хімічної реакції, що відбувається.
3. Обчисліть молярну масу органічної сполуки за формулою відносної густини газів.
4. Обчисліть кількість вуглекислого газу, що виділився внаслідок реакції.
5. Обчисліть кількість та масу Карбону, що входить до складу органічної сполуки, за кількісним співвідношенням вуглекислого газу й Карбону.
6. Обчисліть кількість води, що утворилась унаслідок реакції.
7. Обчисліть кількість та масу Гідрогену, що входить до складу органічної сполуки, за кількісним співвідношенням води та Гідрогену.
8. Визначте наявність Оксигену у складі органічної сполуки. Якщо m(O) > 0, то в складі органічної сполуки містяться атоми Оксигену. Якщо m(O) = 0, то в складі органічної сполуки атоми Оксисену відсутні ( у цьому випадку дія 9 не виконується).
9. Обчисліть кількість Оксигену, що входить до складу органічної сполуки.
10. Запишіть кількісне співвідношення елементів, що входять до складу органічної речовини
11. Вкажіть емпіричну формулу органічної сполуки та обчисліть за цією формулою молярну масу.
12. Встановіть молекулярну формулу органічної речовини. Для цього порівняйте значення молярної маси органічної сполуки й емпіричної формули та визначте, у скільки разів потрібно збільшити індекси емпіричної формули.
|
Тренувальні задачі
9. Унаслідок спалювання органічної речовини масою
10. Під час згоряння речовини масою
11. Під час згоряння речовини масою
12. Під час згоряння речовини масою
13. Під час згоряння речовини масою
14. Унаслідок спалювання вуглеводню масою
|
Електронний підручник з хімії
Перейди за посиланням виконай завдання
виконай завдання
 виконай завдання
виконай завданняЗавдання скоро будуть.
Розчини .Електролітична диссоціація.Йонні рівняння.
В посібнику міститься теоретичний матеріал з теми для самостійного опрацювання, завдання для перевірки знань.
перейти за посиланням Ознайомлення із зразками золей та гелів
Ознайомлення із зразками золей та гелів
Перейти за посиланням

Розпізнавання йонів в розчинах.
Візначення характеру середовища за допомогою універсального індикатора
Індикатори допомогають визначити середовища.
Візначення характеру середовища за допомогою універсального індикатора
Індикатори допомогають визначити середовища.

Багато квітів та плодів мають подібні речовини і здатні змінювати свій колір в залежності від середовища.Так як розчини індикаторів отримують відварюванням (відвар - це щось на зразок бульйону), то вони, природно, швидко псуються - скисає, пліснявіють. Їх треба готувати безпосередньо перед дослідом.
Візьміть трохи сировини (точна кількість не має значення), покладіть в пробірку, налийте води, поставте на водяну баню і нагрівайте до тих пір, поки розчин не забарвиться. Кожен розчин після охолодження профільтруйте і злийте в приготовлену заздалегідь чисту склянку з етикеткою.
.jpg) |
| Спосіб 2 З чаю каркаде. |

Щоб забезпечити себе індикаторами на весь рік, засушити влітку пелюстки та ягоди, розкладіть їх по окремих коробочках, потім точно так само, як говорилося вище, приготуйте з них відвари, окремо з кожної рослини.Щоб дізнатися, який відвар служить індикатором на ту чи іншу середу, і як змінюється його колір, треба провести випробування. Візьміть піпеткою кілька крапель саморобного індикатора і додайте їх по черзі в кислий або лужний розчин. Кислим розчином може служити столовий оцет, а лужним розчин пральної соди, карбонату натрію.
Чай каркаде вже має кисле середовище, в лужному він стає від зеленого до жовтого кольору, а в нейтральному середовищі блідо фіолетовим.
Перейди за посиланням

Саморобні індикатори
Спробуй поекспериментувати.
Тренувальні вправи. Розчини
1. Яка масова частка натрій карбонату в
розчині, добутого в результаті розчинення 5 г солі в 45 г води?
2. Яка масова частка алюміній хлориду в
розчині, якщо в 190 г
води розчинили 10 г
солі?
3. У 25 г води розчинили 15 г калій гідроксиду, яка
масова частка розчиненої речовини у розчині?
4. Скільки грамів купрум (II) сульфату міститься в 15 г 5%-вого його розчину?
5. Скільки грамів ферум (III) хлориду міститься в 40 г 5%-вого його розчину?
6. Яка маса натрій гідроксиду перебуває в 300 г розчину, якщо масова
частка лугу становить 2,5%?
7. Обчисліть масу барій хлориду, що
міститься в 10 г
розчину з масовою часткою солі 10%.
8. Скільки грамів барій хлориду і води
необхідно взяти для приготування 200 г 1%-вого розчину?
9. Скільки грамів арґентум нітрату і
води необхідно взяти для приготування 150 г 5%-вого розчину?
10. Скільки грамів калій йодиду і води
необхідно взяти для приготування 50
г 0,1%-вого розчину?
11. Скільки літрів становитиме 700 г розчину сульфатної
кислоти, якщо його густина дорівнює 1,3 г/мл?
12. Обчисліть масу 0,3 л розчину сульфатної
кислоти, якщо його густина дорівнює 1,4 г/л?
13. Скільки грамів кухонної солі
міститься в 1 л
20%-вого розчину (густина розчину дорівнює 1,11 г/л)?
14. Масова частка магній сульфату в
розчині – 20%. Скільки грамів солі міститься в 200 мл розчину (густина розчину
– 1,22 г/мл)?
15. Скільки грамів натрій карбонату
потрібно взяти для приготування 5
л розчину з масовою часткою солі 13%? (Густина розчину –
1,13 г/мл)
16. Скільки грамів калій сульфату
потрібно взяти для приготування 1,5
л 10%-вого розчину цієї солі ( густина розчину – 1,08
г/мл)?
17. Скільки грамів залізного купоросу
потрібно взяти для приготування 10
л розчину з
масовою часткою ферум (II) сульфату 20% ( густина розчину – 1,07 г/мл)?
18. До розчину калій хлориду масою 200 г , у якому масова частка KCl – 20%, додали розчин цієї ж солі
масою 300 г
, у якому масова частка KCl – 15%. Яка масова частка речовини у добутому розчині?
19. До 200 г розчину нітратної
кислоти додали 200 г
35%-вого розчину цієї ж кислоти. Яка масова частка речовини у добутому розчині?
20. 150 г 30%-вого розчину барій
хлориду змішали з 50 г 10%-вого розчину цієї ж
солі. Обчисліть масову частку розчиненої речовини у новоутвореному
розчині
21. До розчину арґентум нітрату масою 80 г з масовою часткою солі
10% додали 170 г
розчину цієї ж солі з масовою часткою 20%. Яка масова частка речовини в добутому
розчині?
22. До розчину сульфатної кислоти
об’ємом 400 мл, густина якого дорівнює 1,1 г/мл, а масова частка H2SO4 – 0,15, долили воду масою 60 г . Визначити масову частку
сульфатної кислоти в добутому розчині.
23. У воді масою 600 г розчинили амоніак об’ємом
560 мл (н. у.). Визначте масову частку амоніаку в добутому розчині.
24. У 2 л води розчинили 224 л хлороводню (н. у.). З
якою масовою часткою хлороводню утворився розчин?
25. Розчинність амоніаку у воді зазвичай
дорівнює 700 л в одному літрі води, Обчисліть масову частку
амоніаку в такому розчині.
26. Вода об’ємом 1 л поглинула бромоводень
об’ємом 112 л
(н. у.). Визначте масову частку розчиненої речовини у розчині.
27. Мідний купорос масою 25 г розчинили у воді масою 175 г . Визначити масову
частку купрум (II) сульфату в добутому розчині.
28. Скільки грамів залізного купоросу і
води необхідно для приготування 400 г розчину з масовою
часткою ферум (II) сульфату 7%?
29. Визначте масову частку купрум (II) сульфату у розчині, одержаному при
розчиненні 25 г
мідного купоросу в 375 г
води.
30. Визначте масу води, в якій слід
розчинити 25 г
мідного купоросу для одержання розчину купрум (II) сульфату з масовою часткою
розчиненої речовини 4%.
31. Обчисліть маси розчинів з масовою
часткою калій гідроксиду 10% та 50%, необхідні для приготування 800 г розчину з масовою
часткою розчиненої речовини 25%.
32.
Обчисліть маси розчинів з масовою часткою барій хлориду 10% та 50%,
необхідні для приготування 800
г розчину з масовою часткою розчиненої речовини 20%.
33. Обчисліть маси розчинів з масовими
частками речовини 10% та 30%, необхідні для приготування 300 г розчину з масовою
часткою розчиненої речовини 15%.
34. Обчисліть маси розчинів з масовою часткою хлороводню 35% та 10%,
необхідні для приготування 200
г розчину з масовою часткою розчиненої речовини 20
Окисно-відновні реакції.
І рівень. Завдання 1-21 містять чотири варіанти відповідей, з яких
лише одна правильна.
1. Виберіть формулу
речовини, в якій Нітроген має нижчий ступінь окиснення:
а) HNO3;
б) HNO2;
в) NH3;
г) N2O.
2. Виберіть рядок ступенів окиснення Нітрогену відповідно послідовності
сполук NН3, N2О,
NО2, N2О5:
а) –3, +2,
+4, +5;
б) –3, +1, +2, +5;
в) –3, +1,
+4, +5;
г)+3, +1,
+4, +5.
3. Виберіть рядок ступенів окиснення Сульфуру відповідно послідовності
сполук H2S, S, Nа2SО3, SО3:
а) +2, 0,
+4, +6;
б) –2, +1,
+4, +5;
в) –2, 0,
+4, +6;
г) +2, +3,
+4, +6.
4. Виберіть
рядок ступенів окиснення Натрію відповідно послідовності сполук Nа2О,
Nа3N, NаNО2, NаNО3:
а) +1, +3,
+4, +5;
б) однакові
(+1);
в) +2, +1,
+4, +5;
г) +2, +3,
+1, +1.
5. Виберіть твердження щодо реакції
H2S+KMnO4+ H2SO4 → S+MnSO4+K2SO4+H2O:
а) Сульфер відновлюється;
б) Сульфур віддає два електрони;
в) Манган окислюється;
г) Манган
приєднує три електрони.
6. Виберіть твердження щодо реакції
Fe+HCl → FeCl2+H2:
а) ступінь
окиснення Хлору змінюється;
б) ступінь окиснення Гідрогену не
змінюється;
в) окисником є Ферум;
г) відновником є Ферум.
7. Виберіть твердження щодо реакції
Zn+HCl→ ZnCl2+Н2:
а) Гідроген окислюється;
б) Цинк віддає два електрони;
в) Хлор приймає електрон;
г) Цинк відновлюється.
8. Виберіть твердження щодо реакції S+KClO3→ SO2+KCl:
а) ступінь окиснення Калію
змінюється;
б) ступіть окиснення Сульфуру
зменшується;
в) Сульфур відновлюється;
г) Хлор відновлюється.
9. Виберіть твердження щодо реакції
Zn+HNO3→Zn(NO3)2+NH4NO3+H2O:
а) степіні окиснення Цинку й
Нітрогену змінюються;
б) окисником є Цинк;
в) Нітроген приймає п’ять
електронів;
г) окисником є Оксиген.
10. Виберіть твердження щодо реакції
Cu+HNO3→Cu(NO3)2+NO+H2O:
а) Нітроген окислюється;
б) Купрум відновлюється;
в) Нітроген приймає два
електрони;
г) Нітроген відновлюється.
11. Виберіть твердження щодо реакції
Mg+H2SO4(к)→MgSO4+H2S+H2O
а) змінюється тільки ступінь
окиснення Магнію;
б) відновником є Магній;
в) Сульфур приймає шість
електронів;
г) відновником є Сульфур.
12. Виберіть формулу речовини, яка є окисником у
реакції
HCl+HNО3(к)→NOCl+Cl2+H2O:
а) HCl;
б) HNО3;
в) NOCl;
г) Cl2.
13. Виберіть формулу речовини, яка є окисником у
реакції
HІ+K2Cr2O7→CrI3+I2+KI+H2O:
а) HІ;
б) K2Cr2O7;
в) CrI3;
г) I2.
14. Виберіть формулу речовини, яка є відновником у
реакції
H2S+K2Cr2O7+H2SO4→S+Cr2(SO4)3+K2SO4+H2O:
а) H2S;
б) K2Cr2O7;
в) H2SO4;
г) S.
15. Виберіть формулу речовини, яка є відновником у
реакції
NаNО2+KMnO4+H2SO4→NaNO3+MnSO4+K2SO4+H2O:
а) NaNO3;
б) KMnO4;
в) H2SO4;
г) NaNO2.
16. Виберіть формулу речовини, яка є відновником у
реакції
Na2SO3+K2Cr2O7+H2SO4→Na2SO4+Cr2(SO4)3+K2SO4+H2O:
а) Na2SO3;
б) K2Cr2O7;
в) H2SO4;
г) Na2SO4.
17. Виберіть формулу речовини, яка є відновником у
реакції
KMnO4+NaBr+H2SO4→MnSO4+Br2+Na2SO4+K2SO4+H2O:
а) KMnO4;
б) NaBr;
в) H2SO4;
г) MnSO4.
18. Виберіть твердження щодо реакції 4FeS+7O2=2Fe2O3+4SO2:
а) окиснюється Ферум;
б) відновлюється Сульфур;
в) окиснюються Оксиген і Сульфур;
г) окиснюються і відновлюється
Натрій.
19. Виберіть твердження щодо реакції 4Na2SO3=3Na2SO4+Na2S:
а) окиснюється Сульфур, а
відновлюється Оксиген;
б) окиснюється і відновлюється
Сульфур;
в) окиснюється Натрій, а
відновлюється Сульфур;
г) окиснюється і відновлюється
Натрій.
20. Виберіть твердження щодо реакції
HIO3+5HI=3I2+3H2O:
а) окиснюється Іод, а
відновлюється Оксиген;
б) окиснюється і відновлюється
Іод;
в) окиснюється Іод, а
відновлюється Гідроген;
г) окиснюється і відновлюється
Оксиген.
21. Виберіть твердження щодо реакції
2(NH4)2CrO4=Cr2O3+N2+2NH3+5H2O:
а) Хром окиснюється, Нітроген
відновлюється;
б) відновлюється Нітроген;
в) змінюють ступінь окиснення
Хром, Оксиген та Нітроген;
г) Хром відновлюється, Нітроген
окиснюється.
ІІ рівень. Завдання 22-38 містять чотири варіанти відповідей, з яких
лише одна правильна.
22.
Виберіть твердження щодо процесу добування метану при пропусканні водню під
високим тиском через нагріте активоване вугілля:
а) Карбон приймає 4 електрони;
б) Карбон є відновником;
в) Гідроген є окисником;
г) цей процес відбувається без
зміни ступенів окиснення елементів.
23. Виберіть
твердження щодо реакції згоряння залізних ошурок у струмені хлору:
а) Ферум віддає три електрони;
б) Ферум віддає два електрони;
в) Хлор віддає два електрони;
г) Ферум приймає два електрони.
24. Виберіть
твердження щодо процесу добування заліза з оксидів у доменній печі з
використанням коксу:
а) відбувається окиснення Феруму;
б) відбувається відновлення
Карбону;
в) відбувається відновлення
Феруму;
г) відбувається утворення ферум
карбону.
25. Виберіть твердження щодо перебігу
окисно-відновних процесів:
а) число електронів, які
віддаються відновником, дорівнює числу електронів, які приймаються окисником;
б) число електронів, які
віддаються відновником більше числа електронів, які приймаються окисником;
в) число електронів, які
віддаються окисником, дорівнює числу електронів, які приймаються відновником;
г) число електронів, які
віддаються відновником, менше числа електронів, які приймаються окисником.
26. Підберіть коефіцієнти в рівнянні реакції та
підрахуйте їх суму
K2Cr2O7+HCl→CrCl3+KCl+Cl2+H2O:
а) 19;
б) 23;
в) 29;
г) 32.
27. Підберіть коефіцієнти в рівнянні реакції та
підрахуйте їх суму
KClО3+ H2С2О4→К2СО3+ ClО2+СО2+Н2О:
а) 8;
б) 13;
в) 17;
г) 21.
28. Підберіть коефіцієнти в рівнянні реакції та
підрахуйте їх суму
Br2+KOH+Cl2→KCl+KBrO3+H2O:
а) 22;
б) 26;
в) 31;
г) 36.
29. Виберіть формулу сполуки, при утворенні якої з
простих речовин Оксиген буде відновником:
а) СО2;
б) OF2;
в) NO;
г) Р2О5.
30. Виберіть формулу сполуки, яка може бути лише
відновником:
а) HClO4;
б) KMnO4;
в) Na2S;
г) K2Cr2O7.
31. Виберіть формулу сполуки, яка може бути лише
окисником:
а) NH3;
б) РН3;
в) КNО3;
г) KCl.
32. Виберіть
формулу сполуки, яка може бути як окисником, так і відновником:
а) Na2SO4;
б) MnO2;
в) CuO;
г) K2CrO4.
33. Виберіть рівняння реакції диспропорціювання:
а) Cl2+H2O=HCl+ HClO;
б) 2KClO3= 2KCl+3O2;
в) 2KNO3= 2KNO2+O2;
г) 2KClO= 2KCl+O2.
34. Виберіть рівняння реакції внутрішньомолекулярного
окиснення-відновлення:
а) 4KClO3=3KClO4+KCl;
б) 3KClO=2KCl+KClO3;
в) Cl2+H2O=HCl+HClO;
г) 2KNO3=2KNO2=O2.
35. Виберіть схему перетворення, яке є процесом
окиснення:
а) KMnO4→MnO2;
б) H3PO4→PH3;
в) HClO→HCl;
г) CO→CO2.
36. Виберіть схему перетворення, яке є процесом
відновлення:
а) Br2→HBr;
б) KCrO2→K2CrO4;
в) H2S→H2SO4;
г) Mg→MgSO4.
37. Виберіть твердження щодо реакції розкладу
калій перманганату:
а) внутрішньомолекулярна
окисно-відновна реакція;
б) міжмолекулярна окисно-відновна реакція;
в) реакція без зміни ступеня
окиснення елементів;
г) реакція диспропорціювання.
38. Виберіть схему перетворення, в якому
змінюються ступені окиснення двох елементів в одній речовині:
а) CuS + O2→Cu + SO2;
б) FeS + HCl→ FeCl2 + H2S;
в) ZnS + О2→ ZnО +SО2;
г) PbS + H2O2→PbSO4 + H2O.
ІІІ рівень
Завдання 39-42 передбачають встановлення відповідностей
понять першого та другого стовпчиків. Відповідь дайте у вигляді цифр і букв.
39. Встановіть відповідність схеми перетворення
кількості електронів, що беруть участь у перетворенні.
Схема перетворення:
1) Mn2+ → MnO4-;
2) MnO42-
→ MnO4-;
3) Mn2+ → MnO42-;
4) MnO4-
→ Mn2+.
Кількість приєднаних або відданих електронів:
а) +5е;
б) -1е;
в) -5е;
г) +4е;
д) -4е.
40. Встановіть відповідність
схеми перетворення кількості електронів, що беруть участь у перетворенні.
Схема перетворення:
1)
Cr3+ → CrO42-;
2) CrO42-
→ CrO2-;
3) Cr2O72-
→ 2Cr3+;
4) 2Cr3+- → Cr2O72-.
Кількість приєднаних або відданих електронів:
а) +2е;
б) +3е;
в) -3е;
г) -6е;
д) +6е.
41.
Встановіть відповідність схеми перетворення реагенту і продукту, що беруть
участь у перетворенні.
Схема перетворення:
1)
Mn → Mn2+ + 2e;
2) Mn → Mn4+ + 4e;
3) Mn7+ + e
→ Mn6+.
Реагент і продукт:
а) Mn → MnO2;
б) KMnO4 → K2MnO4;
в) Mn → MnCl2;
г) KMnO4 → Mn(NO3)2.
42. Встановіть відповідність між
схемою та змістом перетворення.
Схема перетворення:
1)
2Cl- → Cl2;
2) Cl2
→ ClO3-;
3) Cl2 → 2Cl-;
4) ClO3-
→ 2Cl-.
Зміст перетворення:
а) окиснення хлору;
б) окиснення хлорид-йону;
в) відновлення хлору;
г) відновлення хлорат-йону;
д) відновлення хлорид-йону.
Завдання 43-50 містять чотири варіанти відповідей, з яких кілька
правильні. Вкажіть усі правильні відповіді.
43. Вкажіть твердження щодо реакції
HNO2 + KMnO4 + H2SO4
→ HNO3 +
MnSO4 + K2SO4 + H2O:
а)
Манган приймає п’ять електронів;
б)
Нітроген приймає два електрони;
в) сума коефіцієнтів у
правій частині рівняння дорівнює 11;
г) сума коефіцієнтів у лівій
частині ревняння дорівнює 10.
44. Вкажіть твердження щодо реакції
Cl2 + KOH → KCl + KClO3 + H2O:
а) коефіцієнт біля хлору 6;
б) коефіцієнт біля калій
хлориду 10;
в) сума коефіцієнтів у
правій частині рівняння дорівнює 18;
г) сума коефіцієнтів у лівій
частині рівняння дорівнює 18.
45. Вкажіть твердження щодо реакції
Cu + HNO3(80%) → Cu(NO3)2 + NO2 + H2O:
а) Купрум приймає два
електрони;
б) Нітроген приймає один
електрон;
в) в реакції утворюється
газоподібний нітроген (ІV) оксид;
г) Нітроген віддає три
електрони.
46. Вкажіть твердження щодо реакції
MnSO4 + Br2 + KOH→ KMnO4 + KBr + …:
а) сума коефіцієнтів у
правій частині рівняння дорівнює 22;
б) сума коефіцієнтів у лівій
частині рівняння дорівнює 23;
в) Бром є відновником;
г) Манган (II) сульфат є окисником.
47. Вкажіть твердження щодо реакції
Mn(NO3)2 + PbO2 +
HNO3 → HMnO4 + Pb(NO3)2 + …:
а) сума коефіцієнтів у
правій частині рівняння дорівнює 7;
б) сума коефіцієнтів у лівій
частині рівняння дорівнює 13;
в) Плюмбум відновлюється;
г) Нітроген окислюється.
48. Вкажіть твердження щодо реакції
Br2 + KOH → KBrO + KBr + …:
а) сума коефіцієнтів у
правій частині рівняння дорівнює сумі коефіцієнтів у лівій частині рівняння;
б) Бром окиснюється;
в) Бром відновлюється;
г) Калій не змінює ступінь
окиснення.
49. Вкажіть твердження щодо реакції
CoCl2 + NaOH + H2O2
→ Co(OH)3 + …:
а) сума коефіцієнтів у
правій частині рівняння дорівнює 6;
б) сума коефіцієнтів у лівій
частині рівняння дорівнює 7;
в) утворюється натрій
хлорид;
г) Кобальт відновлюється.
50. Вкажіть твердження щодо реакції
Pb(NO3)2+K2CrO4→
PbCrO4+…:
а) реакція протікає без
зміни степеня окиснення елементів;
б) Хром віддає два елементи;
в) Нітроген приймає два
електрони;
г) Утворюється калій нітрат.
Швидкість хімічної реакції
Перейди за посиланням виконай завдання
виконай завдання
 виконай завдання
виконай завданняВплив концентрації
Вплив температури
Вплив площі поверхні стикання реагуючих речовин
Хімічні реакції
1. За термохімічним рівнянням: S + O2 → SO2; ∆H = -297 кДж обчисліть, скільки теплоти виділиться під час
згоряння сірки масою 64 г .
2. Термохімічне рівняння реакції
горіння фосфору: P + O2 → P2O5; ∆H = -1010 кДж. Скільки теплоти
виділиться при згорянні 6,2 г
фосфору?
3. Термохімічне рівняння реакції
розкладання вапняку:
CaCO3
→ CO2 + CaO; ∆H = + 157 кДж. Скільки теплоти
витрачається на розкладання 200
кг кальцій карбонату?
4. За термохімічним рівнянням H2 + Cl2 → HCl; ∆H = -184 кДж обчисліть, скільки теплоти виділиться, якщо в
реакцію вступає водень об’ємом 5,6
л (н. у.).
5. Який об’єм кисню (н. у.)
витрачається на згоряння вугілля, якщо при цьому виділилось 505 кДж?
Термохімічне рівняння: C + O2 → CO2; ∆H = - 402 кДж.
6. Термохімічне рівняння горіння
метану: CH4
+ O2 → CO2 + H2O; ∆H = - 892 кДж. Який об’єм карбон (IV) оксиду утворюється, якщо при цьому
виділилось 1046,7 кДж?
7. Для зварювання рейок за методом
алюмотермії використовують суміш алюмінію та Fe3O4. Складіть термохімічне рівняння, якщо під час
утворення 0,5 кг
заліза виділилось 3170 кДж теплоти.
8. Під час взаємодії 2,1 г заліза з сіркою
виділилось 3,77 кДж. Обчисліть тепловий ефект реакції.






















Немає коментарів :
Дописати коментар